קרצינומה פיברולמלרית (FLC), סרטן כבד נדיר בקרב צעירים, נגרמת על ידי היתוך גנים עקב מחיקת כרומוזום 19, שהתגלתה על ידי המעבדה של סנפורד מ. סיימון בשנת 2014. מחקר שנערך לאחרונה מאותה מעבדה גילה כי הסרטן מונע על ידי ייצור יתר של חלבון PKA, לא על ידי שינויים מבניים בקינאז.
מחקר שנערך לאחרונה הגדיר מחדש את הגורם לקרצינומה פיברולמלרית, סרטן כבד נדיר, והראה כי הוא נובע מייצור יתר של חלבון PKA ולא מיזוג גנים, מה שפותח אפיקים פוטנציאליים לטיפול חדש.
היה קשה מאוד לאתר את הגורם לסוגי סרטן רבים – ונראה שלרבים יש יותר ממקור אחד. עם זאת, קרצינומה פיברולמלרית (FLC) היא כזו שמדענים חשבו שהצליחו לתקוע.
מחלה נדירה וחשוכת מרפא, התוקפת את הכבד של ילדים, מתבגרים ומבוגרים צעירים, FLC נגרמת כאשר מחיקה קטנה בכרומוזום 19 גורמת לאיחוי של שני גנים, תגלית שהתגלתה בשנת 2014 במעבדתו של סנפורד מ. סיימון מרוקפלר. , שבתו המתבגרת דאז, אלנה, לא רק אובחנה עם מחלת כבד כמה שנים קודם לכן, אלא הייתה מובילה בצוות שמצא את ההיתוך.
גן אחד הוא DNAJB1אשר מייצר חלבונים מכת חום המעודדים הומאוסטזיס של התא, והשני הוא PRKACA, המחולל של תת-היחידה הקטליטית של חלבון קינאז A (PKA), המהווה מפתח לתפקוד מטבולי תאי. שינויים בקינאזות, אשר משנים מולקולות רבות אחרות, היו מעורבים בהנעת סוגי סרטן רבים.
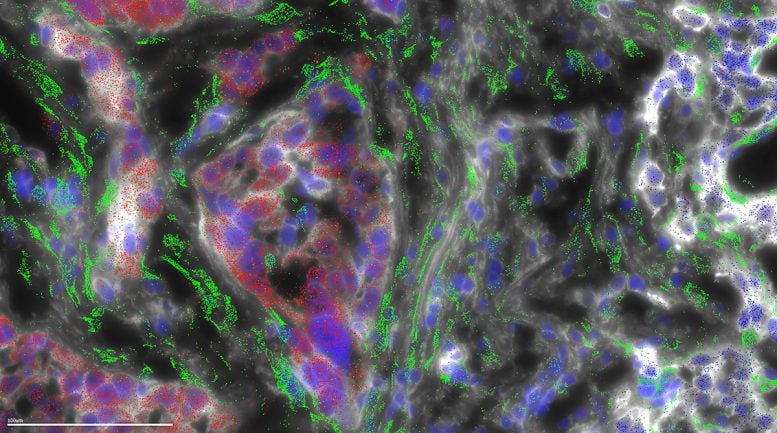
קרצינומה פיברולמלרית (FLC) מקבלת את שמה מהרצועות הסיביות של קולגן שעוברות דרך הגידול. במחקר הנוכחי נעשה שימוש במיקרוסקופיה כדי למפות היכן מתבטאים הגנים השונים בגידול FLC. מיקרוסקופיה זו מראה כי הקולגן נוצר לא על ידי תאי הגידול של ה-FLC (אדומים), אלא במקום זאת בתאי המארחים הפרוסים (הירוקים) הנקראים תאי סטלט, בתגובה לתאי ה-FLC. קרדיט: מעבדה לביופיזיקה תאית באוניברסיטת רוקפלר
בעשור האחרון חשבו שההיתוך הזה יצר שינוי מסוג פרנקנשטיין ב-PKA כך שזרע הרס בתא. כעת חוקרים במעבדה של סיימון גילו תגלית מפתיעה: חלבון ההיתוך מתנהג בדיוק כמו קינאז רגיל. אבל תאים המכילים תוספת לתת-היחידה הקטליטית שלהם מייצרים את הקינאז בכמויות מוגזמות – וזה האשם האמיתי.
"זהו למעשה ביטוי יתר של חלבון בשם PKA שגורם לסרטן", אומר הסופר הראשון מחסה שיראני, פוסט-דוקטורנט במעבדה לביופיזיקה תאית, בראשות סיימון. "לממצאים אלה יש פוטנציאל לחשוף את המסלולים של מגוון רחב של סוגי סרטן ולהציע אפשרויות טיפול חדשות."
החוקרים פרסמו את תוצאותיהם ב מחקר הסרטן.
חוסר עכבות
המחקר של שיראני מכוון להבנה מעמיקה יותר של מכניקת הגן המאוחד מאז תקופתה כדוקטורט. סטודנטית ועוזרת הוראה במעבדה של הביוכימאית ברברה ליונס מאוניברסיטת ניו מקסיקו סטייט, שהמחקר שלה בנושא FLC הונע על ידי האבחנה של בנה שלה עם המחלה. כמו אלנה סיימון ומטופלים רבים אחרים, בנה, ג'קסון קלארק, העמיד את חייו על המתנה כדי לחקור את המחלה במעבדת סיימון. המאמר הראשון שלו מהמעבדה פורסם בשנה שעברה. קלארק נפטר מ-FLC.
לצורך המחקר הנוכחי, שיראני ניתחה דגימות רקמת גידול מחולי FLC באמצעות ספקטרומטריית מסה, ביוכימיה ואימונופלואורסצנטיות כדי לכמת את רמת החלבון ברקמת הגידול של המטופלים. היא גם השוותה אותם לרקמת כבד רגילה.
חפירה עמוקה יותר, היא גילתה שבתאי הגידול יש חוסר איזון מולקולרי: כמות מוגברת של חלבונים קטליטיים עולה על מספר החלבונים המעכבים שבדרך כלל פוגעים וממקמים את הראשונים. לעודף זה יש שתי השפעות עמוקות על התא. האחת היא שפעילות PKA מתגברת, ללא בדיקה. השני הוא ש-PKA כעת חופשי לנוע ברחבי התא, גורם להרס בנקודות שלרוב אין לה גישה אליהן, כולל הגרעין.
התוצאות של שיראני מצביעות על כך שהעובדה שתת-היחידה הקטליטית הפעילה גוברת על המרכיבים המעכבים שלה היא מה שחשוב, לא שינוי מבני בקינאז עצמו.
בבדיקת תיאוריה זו, החוקרים מצאו שהם יכולים ליצור מחדש את המחלה בתאי כבד אנושיים רק על ידי הגדלת כמות הקינאז הרגילה. הם גם מצאו שלחלק מהחולים היה גן שונה לחלוטין שהתמזג לקצה הקדמי של אותו קינאז, PRKACA, מה שמעיד על כך שלא ניתן לייחס את הגורם האמיתי למחלה לחלק הנוסף שנוסף לקינאז.
"הראינו שזה לא משנה מה התמזגתם ל PRKACA גֵן. זה יכול להיות DNAJB1 אוֹ ATP1B1או שזה יכול להיות כלום – סתם PRKACA שיש לו ביטוי חלבוני גבוה", היא אומרת. "כל מצב מוביל לאותו פנוטיפ של סרטן."
החוקרים אישרו את ממצאיהם באמצעות כלי ייחודי שעמד לרשותם. בעשור האחרון, מעבדת סיימון הפעילה את מאגר הרקמות הפיברולמלר. כאשר החוקרים חזרו על הדגימות שלהם, הם נתקלו בארבעה חולים שהיו להם מה שנראה כמו פיברולמלר אך לא היה להם היתוך PRKACA. במקום זאת, השינוי היחיד שהם מצאו היה אובדן של החלבון המעכב, מה שסיפק ראיות נוספות לכך שכמות תת-היחידה הקטליטית ביחס לרכיבים הרגולטוריים שלה הייתה גורם מפתח בהיווצרות מחלה.
אופק טיפול
הממצאים עשויים להוביל לטיפולים טיפוליים ראשונים עבור FLC מעבר להסרה כירורגית של גידולים, אומר שיראני. (הטיפולים הזמינים לאנשים עם סרטן כבד שכיח אינם מועילים עבור FLC, שיש לו פרופיל מולקולרי שונה לחלוטין.)
רעיון אחד הוא לאתר אתרי קישור בחלבון DNAJB1 שאליהם יכול מעכב תרופה להיקשר. אחר הוא הבלטה של הביטוי של PKA. המעבדה בודקת כעת את שתי האפשרויות.
לגישה האחרונה יכולה להיות פוטנציאל מעבר ל-FLC, אומר שיראני, מכיוון שחוסר ויסות PKA קשור למחלות רבות אחרות. לדוגמה, גידול האדרנל שגורם לתסמונת קושינג הוא תוצאה של מוטציה באותה תת-יחידה קטליטית ממש, PRKACA. (תגלית זו נעשתה על ידי נשיא רוקפלר ריצ'רד פ. ליפטון ב-2014.)
כמו בטיפול FLC פוטנציאלי, המפתח יהיה להפריע לתהליכי איתות במורד ייצור ה-PKA, לפני שהגייזר של ייצור חלבון ישבש את התא.
שיראני גם מציעה שמדידת רמות חלבון המיוצרות על ידי גנים שעברו מוטציה עשויה להיות צעד ראשון להבנה טובה יותר של מספר סוגי סרטן: "אולי הרמה המוגברת, או המיקום, של חלבונים היא בעצמה הסיבה."
הממצאים עשויים גם להאיר את הפתוגנזה של מחלות באופן כללי – אחת הסיבות החשובות הרבות לחקר מחלות נדירות, שלעתים קרובות נתפסות כחסרות משמעות מכיוון שהן משפיעות על כל כך מעט אנשים, אומר סיימון.
"יש כל כך הרבה סיבות טובות ללמוד אותם", הוא אומר. "הרבה מחלות נדירות מאופיינות בצורה מדויקת מאוד, מה שמאפשר להתקדם במהירות, ולעתים קרובות ניתן להכליל את התוצאות הללו למחלות נפוצות. לדוגמה, למדנו על המושג 'מדכא גידולים' מחקר סרטן הילדות הנדיר רטינובלסטומה".
"אני גם חושב שככל שאנו מגדירים מחלות בצורה מדויקת יותר, אנו מגלים שרבות שנחשבו כמחלות בודדות הן למעשה אוספים של מחלות נדירות שונות החולקות מאפיין או מנגנון משותף כלשהו", הוא מוסיף.